Avant de lire l’article, ou pendant, je vous conseille de jeter un coup d’œil à l’astuce concernant les différentes fonctions chimiques ; ici nous nous concentrons particulièrement sur la fonction alcool, mais son oxydation fait intervenir plusieurs fonctions !
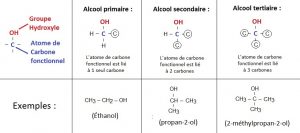
Un alcool est un composé dans lequel un groupe hydroxyle -OH est lié à un atome de carbone tétragonal, c’est-à-dire formant 4 liaisons simples.
On distingue 3 classes d’alcools :
Remarque : Le méthanol est un alcool sans classe, car son carbone fonctionnel n’est lié à aucun autre carbone.
Rappels :
- Une oxydation ménagée est une réaction au cours de laquelle la chaîne carbonée du produit organique est conservée.
- L’oxydation ménagée permet d’arrêter l’oxydation avant qu’elle soit totale, (la plupart du temps, on utilise le réactif de Collins-Sarrett sur les alcools primaires, pour que l’oxydation s’arrête à la fonction aldéhyde et non pas à la fonction acide carboxylique).
- La nomenclature des alcools dérive de celle des alcanes en remplaçant le e final par la terminaison -ol.
- Si la fonction alcool n’est pas la fonction prioritaire, le groupe OH est indiqué par le préfixe hydroxy-. (l’ordre de priorité des fonctions chimiques fera prochainement l’objet d’une astuce).
- Un énol est un composé dans lequel un groupe hydroxyle OH est lié à un atome de carbone trigonal, c’est-à-dire formant 2 liaisons simples et une double (molécule B de l’exemple).
- Un phénol est un énol dans lequel le groupe OH est lié à un atome de carbone d’un cycle benzénique (molécule E de l’exemple).
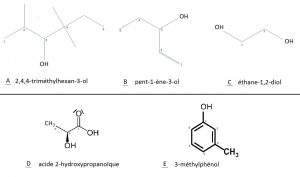
Voici cinq exemples de nomenclatures pour les alcools :
Passons maintenant au vif du sujet, c’est-à-dire à l’oxydation des alcools !
Les alcools ont des propriétés réductrices, c’est à dire qu’ils peuvent s’oxyder en présence d’oxydants particuliers, dont les plus utilisés pour les alcools sont : l’acide hypochloreux, le réactif de Jones, le dichromate de potassium, et le permanganate de potassium (une astuce pour retenir ces quatre oxydants, ainsi que leurs réactions, est en cours de réflexion).
Les flèches suivantes correspondent à une oxydation :
Pour l’alcool le plus simple, le Méthanol (CH3-OH) :
Méthanol (H3C-OH) -> Méthanal (H2C=O) -> Acide méthanoïque (HCOOH) -> Dioxyde de carbone (CO2)
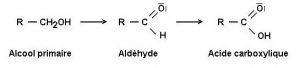
Pour les alcools primaires :
Alcool I (RCH2OH) -> Aldéhyde (RCHO) -> Acide carboxylique (RCOOH)
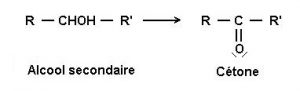
Pour les alcools secondaires :
Alcool II (RR’CHOH) -> Cétone (RR’C=O)
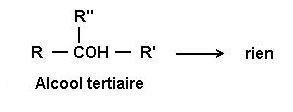
Pour les alcools tertiaires (RR’R’ ‘ COH), il n’y a pas d’oxydation.
L’Astuce mnémotechnique :
Pour faire d’une pierre deux coups et retenir l’ordre d’oxydation des alcools primaires et secondaires, il faut s’imaginer dire à Loïc la « blague » suivante :
« Ola Loïc, tu carbures !
Mais non, je déconne ! Tu t’oxydes !! »
Pour Méthanol I -> Aldéhyde -> Acide carboxylique (-oïque) -> Dioxyde de carbone
Pour Alcool II -> Cétone
Rappels avant l’exemple d’une oxydoréduction :
- Une équation d’oxydoréduction (redox) implique un échange d’électron (e-).
- Dans une équation redox, l’espèce chimique qui capte les électrons (e-) est appelée ‘oxydant’ et celle qui les cède ‘réducteur’. Pour s’en souvenir, il faut penser au fait que l’oxydant ‘ronge’, il ‘s’attaque’ donc au réducteur pour lui prendre ses électrons.
- Usuellement, les couples redox s’écrivent sous la forme (Ox/Réd), pour s’en souvenir pensez à l’ordre alphabétique, le O avant le R.
Pour compléter cet article, voici un exemple d’oxydation d’un alcool primaire (éthanol : C2H6O), avec le permanganate de potassium comme oxydant (KMnO4 : MnO4- + K+, le K+ n’est pas pris en compte), qui donnera un aldéhyde, l’éthanal (C2H4O). On fera donc réagir MnO4- avec C2H6O.
Rappel avant l’écriture des demi-équations redox :
Etape 1 : Équilibrer afin d’assurer la conservation de la matière de tous les éléments, à l’exception de O et H.
Etape 2 : Assurer la conservation de la matière en Oxygène en introduisant H2O dans la demi-équation.
Etape 3 : Assurer la conservation de la matière en Hydrogène en introduisant H+.
Etape 4 : Équilibrer les charges en adaptant le nombre d’électrons échangés (les électrons doivent apparaître du coté de l’oxydant).
Etape 5 : Dans le cas de la deuxième demi-équation, il faut inverser le sens de l’équation, de telle sorte à avoir des électrons des deux côtés lorsqu’on ‘fusionne’ les deux demi-équations.
Etape 6 : Multiplier les demi-équations de telle sorte à avoir le même nombre d’électrons dans chacune d’entre elle.
Etape 7 : Fusionner les deux demi-équations pour obtenir l’équation chimique !!!
Mise en pratique :
Les couples redox mis en jeu :
- ion permanganate / ion manganèse : (MnO4-(aq)/ Mn2+(aq))
L’oxydant de ce couple est l’ion permanganate et le réducteur l’ion manganèse.
- aldéhyde : éthanal / alcool I : éthanol : (C2H4O(aq)/C2H6O(aq))
L’oxydant de ce couple est l’étanal et le réducteur est l’éthanol.
On fait réagir MnO4- avec C2H6O.
Demi-équations :
1) (MnO4-/Mn2+) (ici le réactif de cette réaction est l’ion permanganate : MnO4-)
Etape 1 : MnO4- = Mn(2+)
(pas de coefficient stœchiométrique, donc pas besoin d’équilibrer)
Etape 2 : MnO4- = Mn(2+) + 4H2O
(MnO4- possède 4 atomes d’Oxygène, il faut donc 4 molécules d’H2O)
Etape 3 : MnO4- + 8H+ = Mn(2+) + 4H2O
(4H2O donne 8 atomes d’Hydrogène (4 x 2 = 8), il faut donc 8H+)
Etape 4 : MnO4- + 8H+ +5e- = Mn(2+) + 4H2O
(coté oxydant, on a +8 (du 8H+) et – 1 (du MnO4-), coté réducteur, on a +2 (du Mn(2+)), donc on a : 8 – 1 = 2 -> 7 = 2 -> 7 – 5 = 2, il faut soustraire 7 par 5 pour obtenir le 2 des réducteurs, on obtient ainsi 5 électrons.
2) (C2H4O/C2H6O) (ici le réactif de cette demi-équation est l’alcool primaire : C2H6O)
Etape 1 : C2H4O = C2H6O
(pas de coefficient stœchiométrique, donc pas besoin d’équilibrer)
Etape 2 : C2H4O = C2H6O
(C2H5O et C2H4O possèdent un seul atome d’oxygène, il n’y a pas besoin d’équilibrer en ajoutant H2O)
Etape 3 : C2H4O + 2H+ = C2H6O
(la somme des H du coté oxydant est de 4, et du coté réducteur est de 6, il faut donc 2H+)
Etape 4 : C2H4O + 2H+ +2e- = C2H6O
(coté oxydant, on a +2 (du 2H+), coté réducteur, on n’a pas de charge, donc on a 2 = 0 -> 2 = 0 +2, il faut donc ajouter 2 à 0 pour obtenir 2 électrons du côté oxydant).
Etape 5 : C2H6O = C2H4O + 2H+ +2e-
(Inversion de la demi-équation pour préparer l’étape 6 !)
Etape 6 : On multiplie les deux demi-équations obtenus :
MnO4- + 8H+ +5e- = Mn(2+) + 4H2O (x2) (obtenue au 1))
C2H6O = C2H4O + 2H+ +2e- (x5)
Etape 7 : On fusionne les deux demi-équations pour obtenir l’équation chimique !
5C2H6O + 2MnO4- + 16H+ +10e- => 5C2H4O + 2Mn(2+) + 8H2O + 10H+ + 10e-
Étape 8 : Vérification rapide de l’équilibre par calcul mental ou sur un petit bout de papier :
On a bien des deux côtés : 5C, 2Mn, 9O, 46H et 10e- !!!
Au final l’équation chimique s’écrit :
5C2H6O + 2MnO4- + 16H+ => 5C2H4O + 2Mn(2+) + 8H2O + 6H+
Conseil : Pour éviter toute confusion, lorsque vous commencez à écrire vos demi-équations, faites en sorte d’avoir l’espèce chimique contenant le plus d’oxygène à gauche, mais si le nombre stœchiométrique de l’oxygène est le même, tentez de mettre l’espèce qui possède le plus d’atomes d’Hydrogène à droite (par exemple, dans le 1) on a mis MnO4- à gauche, et le 2) on a mis le C2H5O à droite). Ce n’est qu’à la fin que l’on inverse la deuxième équation afin d’avoir un même nombre d’électrons de chaque côté
- Différence entre poulpe, pieuvre et calamar - 18 mars 2025
- L’alphabet Arabe : les 28 lettres - 18 mars 2025
- Quelle est la différence entre Jaguar, Léopard et Guépard ? - 18 mars 2025


Toujours faux sur le bilan il y a 10 protons à droite (2 x 5) que l’on élimine en soustrayant aux 16 protons de gauche et l’on obtient :
5C2H6O + 2MnO4- + 6H+ => 5C2H4O + 2Mn(2+) + 8H2O
Salut Adrien Merci infiniment!
C’est claire et facile à comprendre!
Cordialement!
Mai à la fin de l’équilibre les nombres d’hydrogène n’est pas égal au premier membre il y a 46hydroge mai au second 42
5C2H6O + 2MnO4- + 16H+ => 5C2H4O + 2Mn(2+) + 8H2O + 6H+
oui pour cette réaction il y’a un faut des nombres d’hydrogène
Merci
Merci beaucoup
La formule de l’éthanol est fausse..C2H6O!
Coquille corrigée, merci !
Je suis ravi que cet article ait pu t’aider !
salut adrien ! merci beaucoup pour ton aide j’ai tout compris !!!!