Les atomes sont constitués de particules appelées protons, neutrons et électrons, qui sont responsables de la masse et de la charge des atomes.
Étymologiquement, le mot atome vient du grec ἄτομος qui veut dire insécable.
Qu’est-ce qu’un atome ?
Un atome est la plus petite unité de matière qui conserve toutes les propriétés chimiques d’un élément. Les atomes se combinent pour former des molécules, qui interagissent ensuite pour former des solides, des gaz ou des liquides. Par exemple, l’eau est composée d’atomes d’hydrogène et d’oxygène qui se sont combinés pour former des molécules d’eau. De nombreux processus biologiques sont consacrés à la décomposition des molécules en leurs atomes constitutifs afin qu’elles puissent être réassemblées en une molécule plus utile.
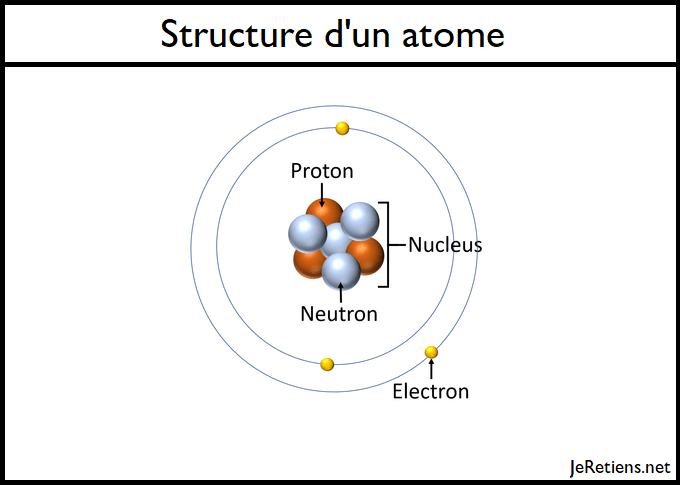
Les particules atomiques: la structure d’un atome
Les atomes sont constitués de trois particules de base : les protons, les électrons et les neutrons.
Le noyau (centre) de l’atome contient les protons (chargés positivement) et les neutrons (sans charge). Les régions les plus éloignées de l’atome sont appelées enveloppes électroniques et contiennent les électrons (chargés négativement) qui gravitent autour du noyau. Les atomes ont des propriétés différentes selon la disposition et le nombre de leurs particules de base.
L’atome d’hydrogène (H) ne contient qu’un proton, un électron et aucun neutron. Cela peut être déterminé à l’aide du numéro atomique et du numéro de masse de l’élément.
La masse atomique
Les protons et les neutrons ont approximativement la même masse, environ 1,67 × 10-24 grammes. Les scientifiques définissent cette quantité de masse comme une unité de masse atomique unifiée (notée u ou uma) ou un Dalton. Bien que de masse similaire, les protons sont chargés positivement, tandis que les neutrons n’ont pas de charge. Par conséquent, le nombre de neutrons dans un atome contribue de manière significative à sa masse, mais pas à sa charge.
Les électrons sont beaucoup plus petits en masse que les protons, ne pesant que 9,11 × 10-28 grammes, soit environ 1/1800 d’une unité de masse atomique unifiée. Par conséquent, ils ne contribuent pas beaucoup à la masse atomique globale d’un élément. Lorsque l’on considère la masse atomique, il est d’usage d’ignorer la masse des électrons et de calculer la masse de l’atome en se basant uniquement sur le nombre de protons et de neutrons.
Les électrons contribuent grandement à la charge de l’atome, car chaque électron a une charge négative égale à la charge positive d’un proton. Les scientifiques définissent ces charges comme « +1 » et « -1 » : dans un atome neutre non chargé, le nombre d’électrons en orbite autour du noyau est égal au nombre de protons à l’intérieur du noyau. Dans ces atomes, les charges positives et négatives s’annulent, ce qui donne un atome sans charge nette.
| Protons, neutrons et électrons | |||
| Charge | Masse atomique | Localisation | |
| Protons | +1 | 1 | Noyau (nucléus) |
| Neutrons | 0 | 1 | Noyau (nucléus) |
| Électrons | -1 | 0 | Enveloppe électronique (gravite autour du noyau) |
Les protons et les neutrons ont tous deux une masse de 1 uma et se trouvent dans le noyau. Cependant, les protons ont une charge de +1, et les neutrons ne sont pas chargés. Les électrons ont une masse d’environ 0 u, sont en orbite autour du noyau et ont une charge de -1.
Volume des atomes
Compte tenu de la taille des protons, des neutrons et des électrons, la plus grande partie du volume d’un atome – plus de 99 % – est en fait un espace vide. Malgré tout cet espace vide, les objets solides ne se contentent pas de passer les uns à travers les autres. Les électrons qui entourent tous les atomes sont chargés négativement et font que les atomes se repoussent les uns les autres, ce qui empêche les atomes d’occuper le même espace. Ces forces intermoléculaires vous empêchent de tomber à travers un objet comme votre chaise.
Synthèse sur la structure des atomes
Un atome est composé de deux régions: le noyau, qui se trouve au centre de l’atome et contient des protons et des neutrons, et la région extérieure de l’atome (enveloppe électrique), qui maintient ses électrons en orbite autour du noyau.
Les protons et les neutrons ont approximativement la même masse, environ 1,67 × 10-24 grammes, que les scientifiques définissent comme une unité de masse atomique unifiée (u) ou (uma) ou encore un Dalton.
Chaque électron a une charge négative (-1) égale à la charge positive d’un proton (+1).
Les neutrons sont des particules non chargées qui se trouvent dans le noyau.
Définitions
Atome : La plus petite quantité possible de matière qui conserve son identité d’élément chimique, constituée d’un noyau entouré d’électrons.
Proton : Particule subatomique chargée positivement, faisant partie du noyau d’un atome et déterminant le numéro atomique d’un élément. Il pèse 1 uma.
Neutron : Particule subatomique faisant partie du noyau d’un atome. Il n’a pas de charge. Sa masse est égale à celle d’un proton ou elle pèse 1 uma.
- Comprendre Emmanuel Kant - 13 mai 2025
- Les stratégies Martingale et Fibonacci fonctionnent-elles à la roulette ? - 14 avril 2025
- Les mathématiques derrière les gains aux machines à sous - 29 octobre 2024


Ping : Centre d'essaie atomique cesta | Pearltrees