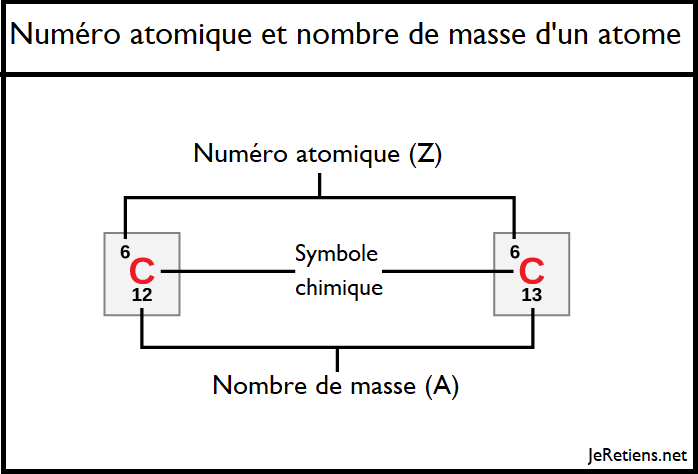
Le numéro atomique est le nombre de protons dans un élément, tandis que le numéro de masse est le nombre de protons plus le nombre de neutrons, ce qu’on appelle le nucléon.
Le numéro atomique
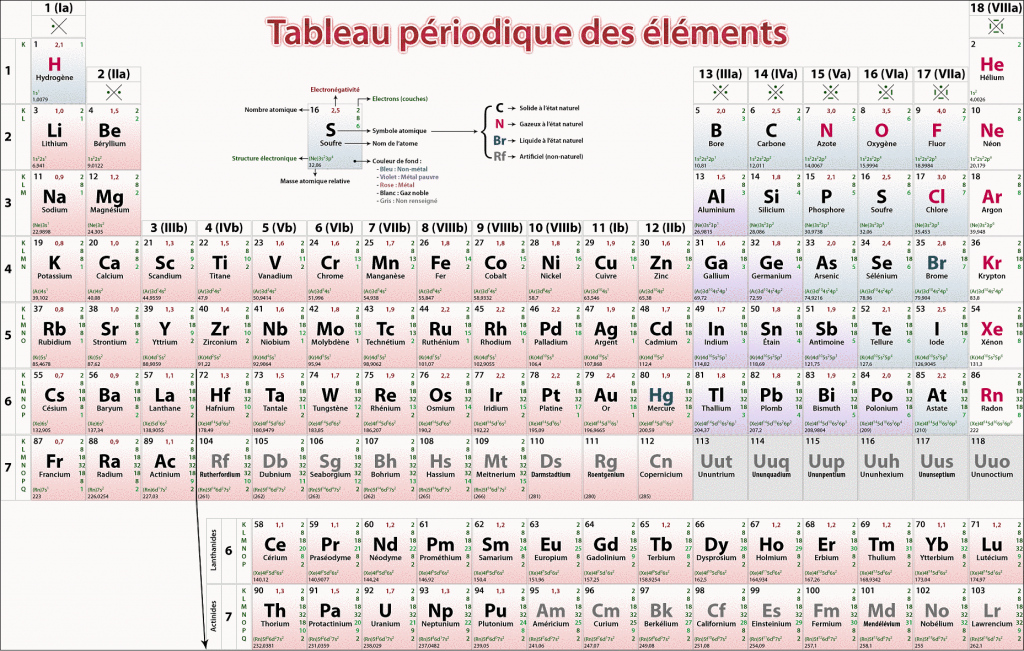
Les atomes neutres d’un élément contiennent un nombre égal de protons et d’électrons. Le nombre de protons détermine le numéro atomique (Z) d’un élément et permet de distinguer un élément d’un autre. Par exemple, le numéro atomique du carbone (Z) est 6 parce qu’il a 6 protons. Le nombre de neutrons peut varier pour produire des isotopes, qui sont des atomes d’un même élément ayant un nombre différent de neutrons. Le nombre d’électrons peut également être différent dans les atomes d’un même élément, produisant ainsi des ions (atomes chargés). Par exemple, le fer, Fe, peut exister à l’état neutre, ou dans les états ioniques +2 et +3.
Le nombre de masse
Le nombre de masse d’un élément (A) est la somme du nombre de protons et du nombre de neutrons. La faible contribution de la masse des électrons n’est pas prise en compte dans le calcul du nombre de masse (voir structure d’un atome). Cette approximation de la masse peut être utilisée pour calculer facilement le nombre de neutrons d’un élément en soustrayant simplement le nombre de protons du nombre de masse. Les protons et les neutrons pèsent tous deux environ une unité de masse atomique ou uma. Les isotopes d’un même élément auront le même numéro atomique mais des nombres de masse différents.
Les scientifiques déterminent la masse atomique en calculant la moyenne des nombres de masse pour ses isotopes naturels. Souvent, le nombre qui en résulte contient une décimale. Par exemple, la masse atomique du chlore (Cl) est de 35,45 uma car le chlore est composé de plusieurs isotopes, certains (la majorité) ayant une masse atomique de 35 u (17 protons et 18 neutrons) et d’autres ayant une masse atomique de 37 uma (17 protons et 20 neutrons).
Étant donné un numéro atomique (Z) et un numéro de masse (A), vous pouvez trouver le nombre de protons, de neutrons et d’électrons dans un atome neutre. Par exemple, un atome de lithium (Z=3, A=7 amu) contient trois protons (trouvés à partir de Z), trois électrons (car le nombre de protons est égal au nombre d’électrons dans un atome), et quatre neutrons (7 – 3 = 4).
Synthèse sur le numéro atomique et le numéro de masse
Les atomes neutres de chaque élément contiennent un nombre égal de protons et d’électrons.
Le nombre de protons détermine le numéro atomique d’un élément et sert à distinguer un élément d’un autre.
Le nombre de neutrons est variable, ce qui donne des isotopes, qui sont différentes formes d’un même atome qui ne varient que par le nombre de neutrons qu’ils possèdent.
Ensemble, le nombre de protons et le nombre de neutrons déterminent le numéro de masse d’un élément.
Comme les isotopes d’un élément ont des nombres de masse légèrement différents, la masse atomique est calculée en obtenant la moyenne des nombres de masse de ses isotopes.
Définitions
Le numéro de masse est la somme du nombre de protons et du nombre de neutrons dans un atome.
Le nombre atomique est le nombre de protons dans un atome.
La masse atomique est la masse moyenne d’un atome, en tenant compte de tous ses isotopes naturels.
- Comprendre Emmanuel Kant - 13 mai 2025
- Les stratégies Martingale et Fibonacci fonctionnent-elles à la roulette ? - 14 avril 2025
- Les mathématiques derrière les gains aux machines à sous - 29 octobre 2024