Connaissez-vous la différence chimique entre un Acide et une Base ? Si ce n’est pas le cas, voici une explication, ainsi qu’une astuce pour ne plus jamais se tromper entre Acide et Base.
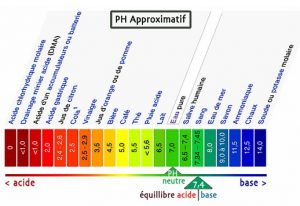
Tout d’abord, pour définir ce qu’on appelle acide et base, il faut définir le pH (potentiel hydrogène). Le pH est une mesure de l’activité chimique des ions hydrogènes H+ (protons) en solution (souvent aqueuse, où les ions présents sont sous la forme d’ion oxonium H3O+ (pH = 0, acide fort), ou d’hydroxyde HO- (pH = 14, base forte), ainsi le pH mesure l’acidité ou la basicité d’une solution.
Une solution de pH = 7 est dite neutre (ordre d’idée : l’eau, salive, sang, lait).
Une solution de pH < 7 est dite acide (ordre d’idée : jus d’orange, vinaigre, acide chlorhydrique).
Une solution de pH > 7 est dite basique (ordre d’idée : savon, chaux, soude, potasse).
Après avoir fait une description générale, voici la définition chimique :
Au sens de Brönsted :
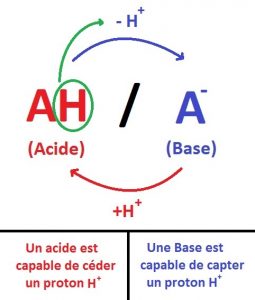
Un acide (noté AH) est une espèce chimique capable de céder (libérer/donner) un proton (H+).
Une base (noté A-) est une espèce chimique capable de capter (arracher) un proton (H+), en effet elle en a besoin.
AH et A- forment un couple acido-basique, ainsi AH/A- sont conjugués.
Astuce : Pour ne plus jamais se tromper, il faut faire l’analogie entre une base Brönsted au sens chimique qui capte des protons, et une base militaire qui capte des informations (des renseignements) !
Remarques :
Cette précédente astuce s’applique pour une base de Brönsted qui capte un proton H+ (en général, lorsqu’on parle d’une base sans préciser sa nature, c’est qu’elle est considérée comme étant une base de Brönsted) ; mais il existe aussi une base de Lewis, qui elle, cède un doublet d’électrons (inversement l’acide de Lewis capte un doublet d’électrons).
- Un acide de Lewis est une molécule qui possède une lacune électronique (symbolisée par un □), ce qui le rend susceptible d’accepter un doublet d’électrons, c’est donc un composé électrophile (qui préfère les électrons au noyau).
En acceptant un doublet d’électrons, cet acide de Lewis crée une liaison covalente avec une base de Lewis.
Exemples d’acide de Lewis :
□AlCl3, □ZnCl2, R-Mg-X, ion □H+
Remarque : L’ion □H+, selon l’exercice donné peut correspondre à de l’acide sulfurique (H2SO4), de l’acide phosphorique (H3PO4), ou encore à l’APTS (acide fort soluble en milieu organique, que l’on utilise aussi lors d’une acétalisation, qui est une réaction de protection des groupes hydroxyles (aussi appelés groupes alcools, OH) d’une molécule).
- Une base de Lewis est une molécule capable de céder un doublet d’électron, c’est un composé nucléophile (qui préfère les noyaux aux électrons).
Exemple de base de Lewis :
HO- (ion hydroxyde), EtO- (ion éthanolate), |NH3 (Ammoniac, avec son doublet non liant sur l’azote N), F- (ion fluorure)
Astuce :
Pour ne pas confondre une base de Brönsted avec une base de Lewis, il faut s’intéresser aux sonorités dans le premier cas (Brönsted/Proton), et à la lettre L dans le deuxième cas : (Lewis/DoubLet d’éLectrons), ainsi :
- Une base de Brönsted capte un proton (comme une base militaire qui capte des informations).
- Une base de Lewis cède un doublet d’électrons.
- Différence entre poulpe, pieuvre et calamar - 18 mars 2025
- L’alphabet Arabe : les 28 lettres - 18 mars 2025
- Quelle est la différence entre Jaguar, Léopard et Guépard ? - 18 mars 2025


Comment on peut calculer le pHisoelectrique de la Cysteine. Sachant que pka-COOH=1.71 et pka-NH2=10.78 et pka-R=8.33 ?
Seul le principe est le même, mais une réaction acido-basique (au sens de Brönsted) implique un échange de protons (H+), alors que la réaction d’oxydoreduction (redox) implique un échange d’électrons (e-).
Dans une équation redox, l’espèce chimique qui capte les électrons est appelée ‘oxydant’ et celle qui les cède ‘réducteur’.
La deuxième différence est que l’usage veut qu’on écrive les couples acide-base (AH/A-) alors que pour les couples redox on l’écrit sous la forme (Ox/Réd).
Enfin, les équations redox se caractérisent par l’écriture des 1/2 équations électroniques.
Exemple de réaction redox :
Fe(s) + Cu2+(aq) => Fe2+(aq) + Cu(s)
Exemple de réaction acido-base :
AH + H2O ⇌ A- + H3O+
est-ce que ses sa qu’on appel l’oxydoréduction ?