Les isotopes sont diverses formes d’un élément qui ont le même nombre de protons, mais un nombre différent de neutrons.
Qu’est-ce qu’un isotope ?
Les isotopes sont différentes formes d’un élément qui ont le même nombre de protons mais un nombre différent de neutrons. Certains éléments, tels que le carbone, le potassium et l’uranium, ont de multiples isotopes naturels. Les isotopes sont définis d’abord par leur élément, puis par la somme des protons et des neutrons présents.
Le carbone 12 (ou 12C) contient six protons, six neutrons et six électrons; il a donc un nombre de masse de 12 uma (six protons et six neutrons).
Le carbone 14 (ou 14C) contient six protons, huit neutrons et six électrons ; sa masse atomique est de 14 uma (six protons et huit neutrons).
Si la masse des différents isotopes est différente, leurs propriétés physiques et chimiques restent pour la plupart inchangées.
Les isotopes diffèrent par leur stabilité. Le carbone 12 (12C) est le plus abondant des isotopes du carbone, représentant 98,89 % du carbone sur Terre. Le carbone 14 (14C) est instable et ne se trouve qu’à l’état de traces. Les isotopes instables émettent le plus souvent des particules alpha (He2+) et des électrons. Des neutrons, des protons et des positrons peuvent également être émis et des électrons peuvent être capturés pour atteindre une configuration atomique plus stable (niveau d’énergie potentielle plus faible) par un processus appelé désintégration radioactive. Les nouveaux atomes créés peuvent être dans un état de haute énergie et émettre des rayons gamma qui diminuent l’énergie mais qui, à eux seuls, ne transforment pas l’atome en un autre isotope. Ces atomes sont appelés isotopes radioactifs ou radio-isotopes.
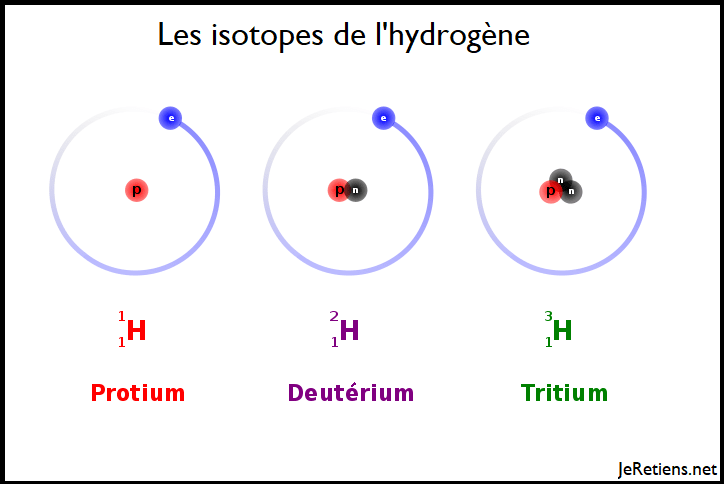
Illustration des isotopes à partir de l’hydrogène
Le schéma ci-dessous illustre les trois isotopes naturels de l’hydrogène.
La datation au carbone 14
Le carbone est normalement présent dans l’atmosphère sous forme de composés gazeux comme le dioxyde de carbone et le méthane. Le carbone 14 (14C) est un radio-isotope naturel créé à partir du 14N (azote) atmosphérique par l’addition d’un neutron et la perte d’un proton, qui est causée par les rayons cosmiques. Il s’agit d’un processus continu, de sorte que plus de 14C est toujours créé dans l’atmosphère. Une fois produit, le carbone 14 se combine souvent avec l’oxygène de l’atmosphère pour former du dioxyde de carbone. Le dioxyde de carbone ainsi produit se diffuse dans l’atmosphère, se dissout dans l’océan et est incorporé par les plantes via la photosynthèse. Les animaux mangent les plantes et, finalement, le radiocarbone est distribué dans toute la biosphère.
Chez les organismes vivants, la quantité relative de carbone 14 dans leur corps est approximativement égale à la concentration de 14C dans l’atmosphère. Lorsqu’un organisme meurt, il n’ingère plus de 14C, de sorte que le rapport entre le 14C et le 12C va diminuer à mesure que le 14C se dégrade pour revenir au 14N. Ce lent processus, appelé désintégration bêta, libère de l’énergie par l’émission d’électrons du noyau ou des positrons.
Après environ 5 730 ans, la moitié de la concentration initiale de carbone 14 aura été reconvertie en azote 14. C’est ce qu’on appelle sa demi-vie, ou le temps qu’il faut à la moitié de la concentration initiale d’un isotope pour se désintégrer et retrouver sa forme plus stable. Comme la demi-vie du 14C est longue, on l’utilise pour dater des objets autrefois vivants comme les vieux os ou le bois. En comparant le rapport entre la concentration de 14C trouvée dans un objet et la quantité de 14C dans l’atmosphère, on peut déterminer la quantité de l’isotope qui ne s’est pas encore désintégré. Sur la base de cette quantité, l’âge du matériau peut être calculé avec précision, pour autant que l’on pense que le matériau a moins de 50 000 ans. Cette technique est appelée datation au radiocarbone, ou datation au carbone 14.
D’autres datations que le carbone 14
D’autres éléments ont des isotopes avec des demi-vies différentes. Par exemple, le 40K (potassium-40) a une demi-vie de 1,25 milliard d’années, et le 235U (uranium-235) a une demi-vie d’environ 700 millions d’années. Les scientifiques utilisent souvent ces autres éléments radioactifs pour dater des objets qui ont plus de 50 000 ans (la limite de la datation au carbone). Grâce à la datation radiométrique, les scientifiques peuvent étudier l’âge des fossiles ou d’autres restes d’organismes éteints.
Synthèse sur les isotopes
Les isotopes sont des atomes d’un même élément qui contiennent un nombre identique de protons, mais un nombre différent de neutrons.
Bien qu’ils aient des nombres de neutrons différents, les isotopes d’un même élément ont des propriétés physiques très similaires.
Certains isotopes sont instables et vont subir une désintégration radioactive pour devenir d’autres éléments.
La demi-vie prévisible des différents isotopes en désintégration permet aux scientifiques de dater les matériaux en fonction de leur composition isotopique, comme dans le cas de la datation au carbone 14.
Définitions
Un isotope est toute forme d’un élément où les atomes ont le même nombre de protons, mais un nombre différent de neutrons dans leur noyau.
La demi-vie est le temps nécessaire à la moitié de la concentration initiale d’un isotope pour revenir à sa forme la plus stable.
Les isotopes radioactifs ont un atome au noyau instable, caractérisé par un excès d’énergie disponible qui subit une désintégration radioactive et crée le plus souvent des rayons gamma, des particules alpha ou bêta.
La datation au radiocarbone permet de déterminer l’âge d’un objet en comparant le rapport entre la concentration de carbone 14 qu’il contient et la quantité de carbone 14 dans l’atmosphère.
- Comprendre Emmanuel Kant - 13 mai 2025
- Les stratégies Martingale et Fibonacci fonctionnent-elles à la roulette ? - 14 avril 2025
- Les mathématiques derrière les gains aux machines à sous - 29 octobre 2024


Vos articles sont parfaits !!
Grand merci à toutes les personnes qui permettent de faire vivre ce site.
Merci Guillaume !