En cinétique chimique, la loi d’Arrhenius permet de décrire la variation de la vitesse d’une réaction chimique en fonction de la température. Cette loi empirique (basée sur les résultats observés par l’expérience) a été énoncée par Svante August Arrhenius en 1889, mais ce n’est qu’en 1910 qu’elle est acceptée, en ayant été vérifiée expérimentalement.
L’équation de cette loi est la suivant :
Avec :
k le coefficient de vitesse (ou constante de vitesse) ; T la température en K (kelvin) ; dln(k)/dT la dérivée du logarithme népérien du coefficient de vitesse par rapport à la température ; R la constante des gaz parfaits (valeur usuelle R = 8,314 J⋅K-1⋅mol-1 ; E l’énergie d’activation d’Arrhenius donnée en J·mol-1 (joule par mole).
Remarque : la loi de Van’t Hoff est analogue à celle d’Arrhenius, il suffit de remplacer le k (coefficient de vitesse) par K° (constante de réaction) et E (énergie d’activation) par ΔrH° l’enthalpie standard de réaction).
Pour retenir la formule, il est possible de mémoriser cette courte phrase en changeant la fin du prénom d’Arrhenius « Svante » par « Svandel », ce qui permet de retenir la phrase suivante : Svandel doit être retraité (depuis tout ce temps.. !), retenez juste : Svandel doit être retraité !
Pour :
- Différence entre poulpe, pieuvre et calamar - 18 mars 2025
- L’alphabet Arabe : les 28 lettres - 18 mars 2025
- Quelle est la différence entre Jaguar, Léopard et Guépard ? - 18 mars 2025

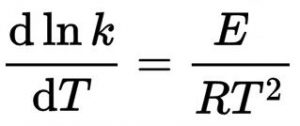
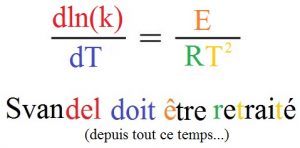

Bravo Adrien ! et merci bcp