Avant d’aborder l’astuce pour ne plus se tromper entre énantiomères et diastéréoisomères, il faut déjà voir quelques notions !
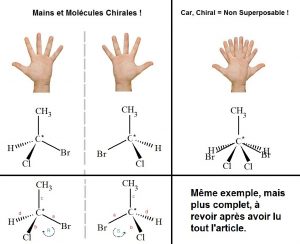
Une molécule est chirale si elle n’est pas superposable à son image dans un miroir, à l’inverse, une molécule est achirale si elle possède un centre de symétrie ou un plan de symétrie.
Un carbone asymétrique (C*) est un atome de carbone lié à 4 groupements d’atomes différents. (Le carbone asymétrique de l’exemple ci-dessous est bien lié à 4 groupes d’atomes différents, le Chlore (Cl), l’Hydrogène (H), le Brome (Br) et le groupe méthyle (CH3).
Par ailleurs, le nombre de carbones asymétriques nous donne le nombre de stéréoisomères de la molécule, en effet, s’il n’y a qu’un carbone asymétrique, il n’y a que 2 stéréoisomères car 2¹ = 2 ; s’il a 2 carbones asymétriques dans la molécule, alors elle possède 4 stéréoisomères car 2² = 4 (comme dans le dernier exemple de l’article).
Remarque : Si une molécule possède à la fois un carbone asymétrique, et plus loin, une double liaison, alors cette molécule possédera 4 stéréoisomères car 2¹+¹ = 2² = 4, en effet, une double liaison équivaut à un exposant, on peut alors retenir la formule suivante :
Nombre de stéréoisomères = 2n+m avec n le nombre de carbone asymétrique et m le nombre de double liaison.
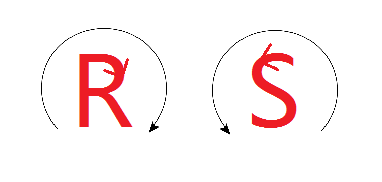
[ A titre d’information : Autour d’un carbone asymétrique (C*), 2 configurations sont possibles, pour les distinguer on utilise deux descripteurs stéréochimiques, soit la configuration R , soit la configuration S.
Pour s’en souvenir, il faut se dire que ‘Right’ (=droit) commence par un R, en effet R signifie qu’on tourne dans le bon sens (en suivant a et b), celui des aiguilles d’une montre. A l’inverse, avec un S, on tourne dans le sens contraire (les stéréodescripteurs seront illustrés avec un exemple en fin d’article).
Ou alors, voici une image imparable pour s’en souvenir :
Ces deux descripteurs stéréochimiques sont régis par les règles de CIP (règles de priorité de Cahn, Ingold et Prelog), qui stipulent :
- Les substituants (liés au carbone asymétrique) sont classés par numéro atomique Z croissant, ainsi les substituants prioritaires sont ceux qui possèdent la plus forte valeur de numéro atomique : I (Iode Z=53) > Br (Brome Z=35) > Cl (Chlore 17) > S (Soufre 16) > P (Phosphore 15) > O (Oxygène 8) > N (Azote 7) > C (Carbone 6) > H (Hydrogène 1)
- Si plusieurs atomes sont identiques, on considère les atomes de rang 2, puis 3 .. jusqu’à trouver un atome de nature différente qui permette une distinction de priorité, en somme il faut trouver un substituant prioritaire.
- Lorsqu’un substituant présente une liaison multiple, celle-ci est considérée comme plusieurs fois une liaison simple, c’est-à-dire qu’une liaison double (C=O) correspond à deux liaisons simples d’oxygène (O).
- On note le substituant prioritaire jusqu’au substituant le moins prioritaire respectivement de a à d.
- Quand le substituant le moins prioritaire se trouve devant (c’est-à-dire la liaison stylisée, complètement noire), on inverse le sens du descripteur stéréochimique (c’est-à-dire que si on tourne normalement dans le sens des aiguilles d’une montre en suivant a b, on a un R, mais puisque que le substituant le moins prioritaire (d) est devant, on inverse le sens, donc on obtient un S).
- Quand le substituant le moins prioritaire est derrière (c’est-à-dire la liaison en pointillé), on ne change pas le sens (si en suivant le sens de a b, on tourne dans le sens des aiguilles d’une montre, donc R, on reste sur le descripteur stéréochimique R).
- Sur les premiers exemples présentés dans l’article, vous pourrez constater la présence de R ou de S. ]
Astuce : Pour se souvenir qu’on inverse le sens lorsque H est devant (liaison stylisée en noire), il faut penser à la lettre « n » présente dans « devant », « noire » et « inverse ».
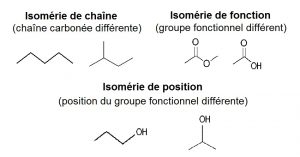
Les isomères de constitution sont des molécules qui ont la même formule brute, mais pas la même formule développée, on distingue les isomères de chaîne (chaîne carbonée différente), isomères de position (position du groupe fonctionnel différente), isomères de fonction (groupe fonctionnel différent).
Les stéréoisomères sont des molécules qui ne diffèrent que par l’arrangement de leurs atomes dans l’espace. On distingue :
- Les stéréoisomères de conformation : on passe d’une conformation à l’autre par simple torsion ou rotation autour d’une liaison simple. La barrière énergétique pour passer d’une conformation à l’autre est faible (10 kJ.mol-1).
- Les stéréoisomères de configuration : on passe d’une configuration à l’autre en cassant des liaisons. La barrière énérgétique est donc plus importante (200 kJ.mol-1).
Les énantiomères et diastéréoisomères sont des molécules chirales (plus particulièrement des stéréoisomères de configurations).
Les énantiomères sont des molécules qui sont images spéculaires (c’est-à-dire qu’elles sont images l’une de l’autre dans un miroir). Par ailleurs, les énantiomères ont les mêmes propriétés physiques (même température de fusion, même solubilité, …), (à l’exception de leur pouvoir rotatoire), de plus, les énantiomères ont aussi les mêmes propriétés chimiques.
Les diastéréoisomères sont des molécules qui ne sont pas des énantiomères, ainsi les diastéréoisomères ne sont pas images l’une de l’autre dans un miroir. Par ailleurs, les diastéréoisomères ne possèdent ni les mêmes propriétés physiques, ni les mêmes propriétés chimiques.
Voici un récapitulatif de toutes ces notions :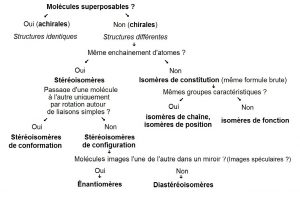
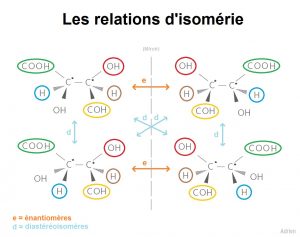
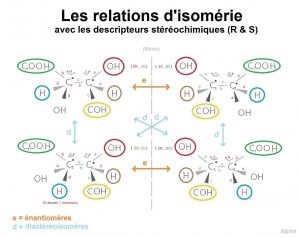
Maintenant, passons à l’astuce pour différencier énantiomères et diastéréoisomères !
Astuces :
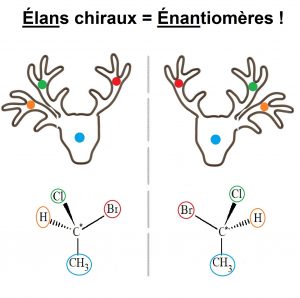
Les molécules énantiomères sont images l’une de l’autre dans un miroir, alors dans ce cas, il faut penser à un élan à 3 bois et avec 4 pastilles de couleurs différentes, une au centre, et les trois autres sur ses trois bois ; ainsi l’élan et son reflet ne sont pas superposables car les bois sont de différentes couleurs (donc chiraux), mais l’élan et son reflet sont images l’un de l’autre (donc énantiomères) ! Pourquoi l’exemple de l’élan ? Eh bien parce que ‘élan‘ c’est comme ‘énantiomères’ !
A l’inverse, les molécules diastéréoisomères ne sont pas images l’une de l’autre dans un miroir, pour s’en rappeler, il faut se dire que le diable n’a pas de reflet dans un miroir, en effet ‘diable’ comme ‘diastéréoisomères’ !
- Différence entre poulpe, pieuvre et calamar - 1 novembre 2021
- Différence entre Mitose et Méiose - 1 novembre 2021
- Les races de vache : les reconnaître - 17 septembre 2019
Merci pour ces explications elles sont très compréhensible.
c’est très bien expliqué, merci encore une fois.